






《化学反应的热效应PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1017 KB,总共有46页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 46页
- 1017 KB
- VIP模板
- ppt
- 数字产品不支持退货
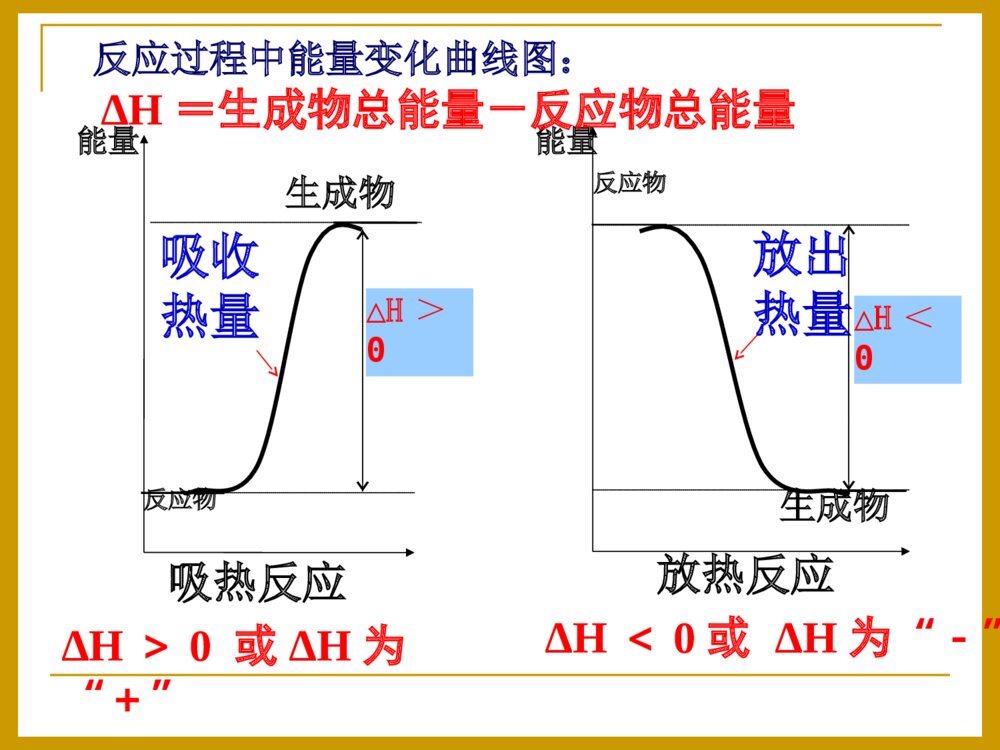
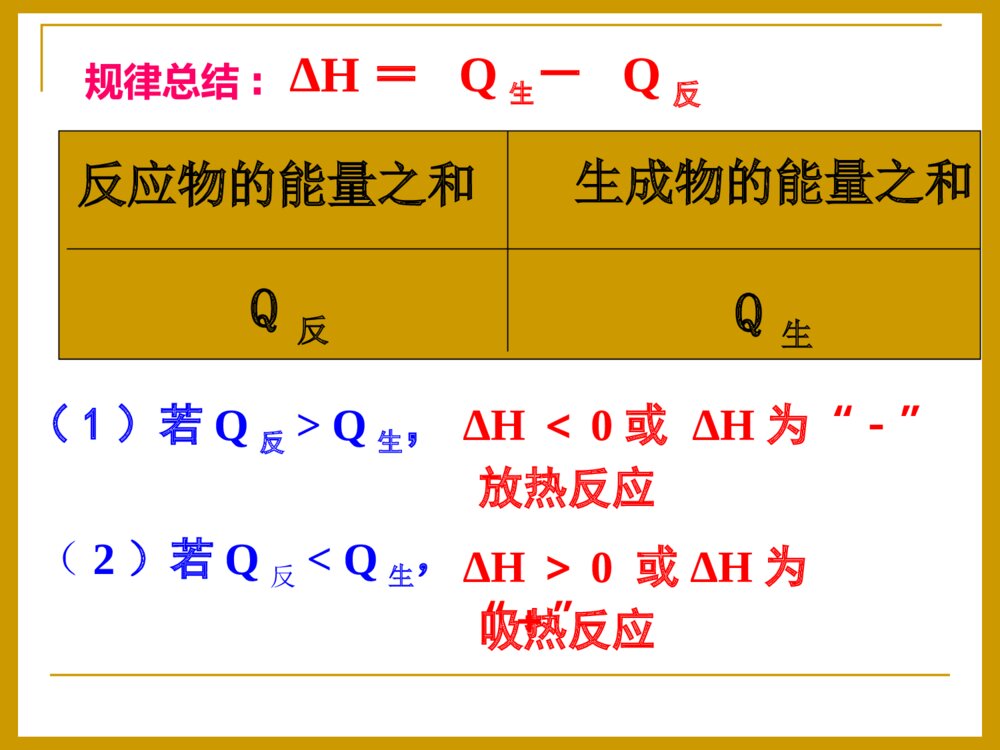
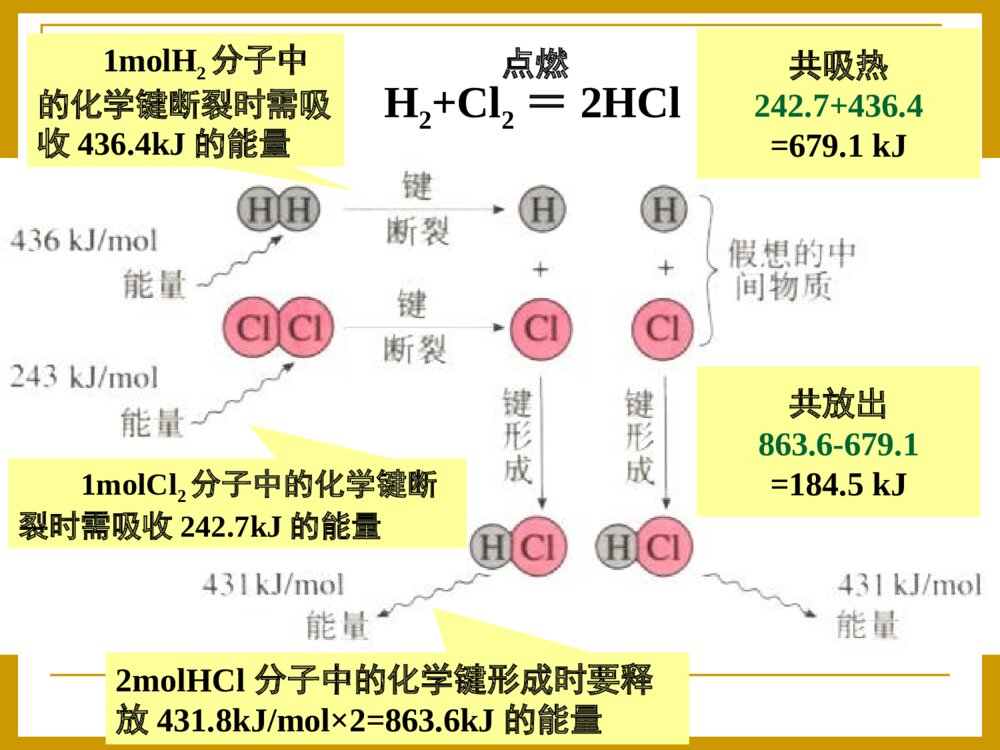
化学反应中的热效应一、反应热和焓变1、反应热:符号:△H单位:kJ·mol-1在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。化学反应过程中,所放出或吸收的热量叫做化学反应的反应热。2、焓变:当∆H为“-”(∆H<0)时,为放热反应;当∆H为“+”(∆H>0)时,为吸热反应.规定(要记住哦!):3、常见的放热反应和和吸热反应⑴常见的放热反应①活泼金属与水或酸的反应。如2Al+6HCl=AlCl3+3H2↑②酸碱中和反应。如2KOH+H2SO4=K2SO4+2H2O③燃烧反应。如C、CO、C2H5OH等的燃烧④多数化合反应。如CaO+H2O=Ca(OH)2,SO3+H2O=H2SO4⑵常见的吸热反应②2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O③C(s)+H2O(g)CO+H2④CO2+C2CO①多数分解反应,如CaCO3CaO+CO2↑高温②2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O高温③C(s)+H2O(g)CO+H2④CO2+C2CO高温⑤盐类的水解工业生产水煤气2、下列变化中,属于吸热反应的是()A.氮气与氢气合成氨B.酸碱中和C.二氧化硫与氧气反应生成三氧化硫D.焦炭与高温水蒸气反应D请你接招:1、下列变化中,属于放热反应的是()A.Ba(OH)2·8H2O与NH4Cl的反应B.点燃的镁条在二氧化碳中继续燃烧C.灼热的碳与二氧化碳的反应D.碱式碳酸铜的受热分解B为什么有的反应会放出热量有的需要吸收热量呢?宏观上决定于反应物的总能量与生成物的总能量的相对大小。问题探究一吸热反应生成物反应物能量吸收热量放出热量反应过程中能量变化曲线图:生成物反应物能量放热反应ΔH=生成物总能量-反应物总能量ΔH<0或ΔH为“-”ΔH>0或ΔH为“+”△H<0△H>0反应物的能量之和Q反生成物的能量之和Q生(1)若Q反>Q生,(2)若Q反E生,(1)若E反0的反应D请你接招:C(s)+H2O(g)CO(g)+H2(g)ΔH=+131.5kJ/mol=二、热化学方程式:1、概念:能够表示反应热(焓变)的化学方程式叫做热化学方程式。2、书写热化学方程式应注意以下几点⑴要注明温度和压强:反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。因为物质的聚集状态不同所含的能量也不同。固态液态吸热气态吸热吸热⑵反应物和生成物要注明聚集状态:H2(g)+O2(g)=H2O(l)△H=-285.8KJ/mol21H2(g)+O2(g)=H2O(g);△H=-241.8KJ/mol21H2O(l)=H2O(g);△H=+44KJ/mol气态(g)、液态(l)、固态(s)、溶液(aq)⑶热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因此可以是整数也可以分数。H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/molH2(g)+Cl2(g)=HCl(g);△H=-92.3KJ/mol2121⑷反应热与参加反应的物质的物质的量有关。同一化学反应中,热化学方程式中物质的化学计量数不同,△H的数值也不同。化学计量数与△H的数值成正比。H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ/mol⑹△H的表示:热化学方程式中的△H的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热⑸可逆反应中的ΔH数值是指该反应完全进行时的数值.⑺热化学反应方程式中都用“=”,不用标反应条件无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,“+”与“-”始终不变,但△H的数值与反应式中的系数成比例当化学反应逆向进行时,数值不变,符号相反。3.书写步骤(1)写出化学方程式(2)注明反应物和生成物的状态(3)标明焓变△H(注意+、-和单位:kJ/mol)☆(4)要注明反应的温度和压强【中学一般不注明,为一个大气压(101kPa),250C(298K)】H2(g)+I2(g)2HI(g)H=△-14.9kJ/mol4、热化学方程式表示的意义⑴表示什么物质参加反应,结果生成什么物质⑵反应物和生成物之间的质量比、物质的量比⑶反应物完全变成生成物后所放出或吸收的热量。质→量→能H2(g)+O2(g)=H2O(g);△H=-241.8KJ/mol21已知:H2(g)+F2(g)=2HF(g)H=-270△kJ/mol,下列说法正确的是A.2L氟化氢气体分解成1L氢气与1L氟气放出270kJ热量B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJC.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量C请你接招⑷已知键能:N≡N946KJ/mol,H-H436KJ/mol,H-N391KJ/mol,写出合成氨反应的热化学方程式。⑴氢气在氯气燃烧生成1摩氯化氢气体,放出92.3kJ的热量1、写出下列反应的热化学方程式(25,101kPa℃时).⑵氢氧化钠溶液与硫酸溶液反应生成2摩液态水,放出114.6KJ的热量⑶1摩石墨转化为金刚石固体需吸收1.5KJ的热量高考怎么考?有下列常见题型:A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=△-4bkJ/molB.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)H=+2bkJ/mol△C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=△-2bkJ/molD.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=+bkJ/mol△例1.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是A2、正误判断现场练兵已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是()A.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)△H=-5518kJ·mol-1B.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ·mol-1C.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)△H=+5518kJ·mol-1D.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)△H=-48.40kJ·mol-1B3、有关热化学方程式的计算例2在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)=2CO2(g)H=△-566KJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l)H=△-890KJ/mol由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为()A.2912KJB.2953KJC.3236KJD.3867KJB2、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol1):P—P:198P—O:360O=O:498则反应P4(白磷)+3O2=P4O6的反应热△H为()A.-1638kJ·mol1B.+1638kJ·mol1C.-126kJ·mol1D.+126kJ·mol1A例1.下列各组热化学方程式中,化学反应的△H前者大于后者的是①.C(s)+O2(g)===CO2(g)H△1C(s)+O2(g)===CO(g)H△2②.S(s)+O2(g)===SO2(g)H△3S(g)+O2(g)===SO2(g)H△4③.H2(g)+O2(g)===H2O(l)H△52H2(g)+O2(g)===2H2O(l)H△6④.CaCO3(s)=CaO(s)+CO2(g)H△7CaO(s)+H2O(l)=Ca(OH)2(s)H△8A.B.C.D.①④②③④①②③21c214、反应热大小的比较△H为正值时,数值越大,H△越大;△H为负值时,数值越大,H△越小.三、燃烧热和中和热:1、燃烧热在250C时,101KPa时,1mol的纯物质完全燃烧生成稳定的物质时放出的热量。温馨提示:⑴书写燃烧热的热化学方程式时,一般以燃烧1mol物质为标准来配平其余物质的化学计量数。⑶完全燃烧的产物是稳定的物质:⑷Q放=n(可燃物)×燃烧热⑵燃烧热与可燃物的物质的量无关。C→CO2H2→H2O(l)NH3→N2H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol2、已知:请问:氢气的燃烧热是多少?285.8kJ/mol1、C(S)+1/2O2(g)=CO(g)△H=-195.4kJ/mol请问:碳的燃烧热为195.4kJ/mol吗?不是请你接招:请你接招2、中和热在稀溶液中,酸与碱发生中和反应生成1molH2O时的反应热。温馨提示:⑶对于稀溶液中强酸与强碱的反应,其中和热基本上是相等的,都约是57.3KJ/mol要记住哦!⑷对于强酸与弱碱,弱酸与强碱,弱酸与弱碱的稀溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol因为弱电解质的电离是吸热过程其中和热一般低于57.3KJ/mol,⑵中和热与酸碱的物质的量无关⑴书写中和热的热化学方程式时,一般以1molH2O为标准来配平其余物质的化学计量数。下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热为57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热2×57.3kJ·mol-1B.CO(g)的燃烧热是283.0kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1C.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热B请你接招D例2.强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);H=-57.3kJ·mol△1,又知在溶液中反应有:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H1=-Q1kJ·mol11/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)△H2=-Q2kJ·mol1HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l)△H3=-Q3kJ·mol1则Q1、Q2、Q3的关系正确的是A.Q1=Q2=Q3B.Q2>Q1>Q3C.Q2>Q3>Q1D.Q2=Q3>Q1C△H2<△H3<△H1如何求算一个体系放出的热量呢?Q=-C(T2-T1)=-C0m(T2-T1)T—温度C—热容,当物质吸收热量温度升高时,温度每升高10C所吸收的热量,称为该物质的热容,单位为J·0C-1C0—比热容,单位质量物质的热容,单位为J·g-1·0C-1m—反应体系中物质的总质量实验的关键:准确测量质量与温度要保温隔热,防止热量的散失四、反应热的测量与计算:简易量热计示意图1、仪器:2、药品:量热计、温度计、环形玻璃搅拌棒、量筒(50ml,两只)0.50mol/L的盐酸0.55mol/L的NaOH溶液活动与探究:测定中和热课本P6例题、50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是。装置上有何要改进?(2)烧杯间填满碎纸条的作用是。(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”“无影响”)。(4)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”“不相等”),所求中和热(填“相等”“不相等”),简述理由:。(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会。(均填“偏大”“偏小”“无影响”)环形玻璃搅拌棒保温隔热,减少实验过程中的热量损失偏小不等相等因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱的用量无关偏小偏小大小烧杯口应相平五、盖斯定律(重要哦!)⑴内容:不管化学反应是一步完成还是分几步完成,其反应焓变是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。⑵应用盖斯定律的计算焓变例1:C(s)+½O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。已知:⑴C(s)+O2(g)=CO2(g)H△1=-393.5kJ/mol⑵CO(g)+½O2(g)=CO2(g)H△2=-283.0kJ/molC(s)+½O2(g)=CO(g)H=-110.5kJ/mol△例2:已知下列反应的反应热为⑴CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol⑵C(s)+O2(g)==CO2(g)H△2=-393.5kJ/mol⑶H2(g)+½O2(g)==H2O(l)H△3=-285.8kJ/mol试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)==CH3COOH(l)△H=-488.3kJ/mol1、已知:①N2(g)+2O2(g)=2NO2(g)H△1=+68kJ/mol②N2H4(l)+O2(g)=N2(g)+2H2O(l)H△2=-622kJ/mol火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2(g)和H2O(l),写出该反应的热化学方程式。N2H4(l)+NO2(g)=3/2N2(g)+2H2O(l)△H=-622kJ/mol–(+68kJ/mol)/2=-656kJ/mol请你接招2、将焦炭转化为水煤气的主要反应为:C(s)+H2O(g)=CO(g)+H2(g)已知:①C(s)+O2(g)=CO2(g)H△1=-393.5kJ/mol②H2(g)+½O2(g)=H2O(g)H△2=-242.0kJ/mol③CO(g)+½O2(g)=CO2(g)H△3=-283.0kJ/mol写出制取水煤气的热化学方程式.C(s)+H2O(g)=CO(g)+H2(g)H=+131.5kJ/mol△请你接招例3、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJmol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为A.-44.2kJ·mol-1B.+44.2kJ·mol-1C.-330kJ·mol-1D.+330kJ·mol-1A3、由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式:。若1g水蒸气转化成液态水放热2.444KJ,则反应H2(g)+½O2(g)=H2O(1)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。请你接招归纳总结:反应热(焓变)的计算的方法⑷盖斯定律⑵ΔH=Q生-Q反⑶ΔH=E反-E生⑴利用热化学方程式计算反应热与物质的物质的量成正比五、能源的充分利用1、什么是能源?常见的能源有哪些?能源的作用是什么?能源就是能提供能量的自然资源,包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。能源是国家国民经济和社会发展的基础。能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平。2、当今世界上重要的能源是什么?怎样解决能源枯竭问题?什么是新能源?节约能源的重要措施是什么?化石燃料:煤、石油、天然气解决的办法:开源节流,即开发新能源,节约现有能源,提高能源的利用率。新能源:太阳能、氢能、风能、地热能、潮汐能和生物能。措施:降低能耗;科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。[议一议]城市家用燃料使用管道煤气比使用煤、煤球等固体燃料有什么优点?首先,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率。其次,气体燃料便于管道运输、使用方便(易点燃、易熄灭)。第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大气污染。气体燃料无渣无尘、清洁卫生。



















